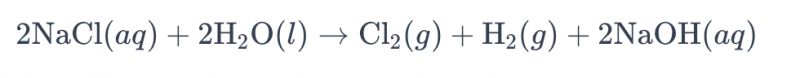La procezo de elektrolizo de sala akvosolvaĵo uzante titanajn elektrodojn por produkti kloron estas ofte nomata "elektrolizo de sala akvo". En ĉi tiu procezo, titanaj elektrodoj estas uzataj por faciligi la oksidigan reakcion de kloridaj jonoj en la sala akvo, kondukante al la generado de klorgaso. La ĝenerala kemia ekvacio por la reakcio estas jena:
En ĉi tiu ekvacio, kloridaj jonoj spertas oksidiĝon ĉe la anodo, rezultante en la produktado de klorgaso, dum akvomolekuloj reduktiĝas ĉe la katodo, produktante hidrogengason. Krome, hidroksidaj jonoj spertas redukton ĉe la anodo, formante hidrogengason kaj natrian hidroksidon.
La elekto de titanaj elektrodoj ŝuldiĝas al la bonega korodrezisto kaj konduktiveco de titanio, kiuj permesas al ĝi stabile sperti la reakcion dum elektrolizo sen korodo. Ĉi tio faras titanajn elektrodojn ideala elekto por la elektrolizo de sala akvo.
La elektrolizo de sala akvo tipe postulas eksteran energifonton por provizi energion por la elektroliza reakcio. Ĉi tiu energifonto estas kutime kontinua kurento (DC) ĉar elektrolizaj reakcioj necesigas koheran direkton de kurentofluo, kaj DC-fonto povas liveri konstantan kurentodirekton.
En la procezo de elektrolizo de sala akvo por generi klorgason, oni kutime uzas malalt-tensian kontinukurentan elektrofonton. La tensio de la elektrofonto dependas de la specifaj reakciaj kondiĉoj kaj ekipaĵdezajno, sed ĝenerale varias inter 2 kaj 4 voltoj. Krome, la kurentintenseco de la elektrofonto estas decida parametro, kiu devas esti determinita surbaze de la grandeco de la reakcia ĉambro kaj la dezirata produktadrendimento.
Resumante, la elekto de elektroprovizo por la elektrolizo de sala akvo dependas de la specifaj postuloj de eksperimentoj aŭ industriaj procezoj por certigi efikan reagon kaj la atingon de la dezirataj produktoj.
Afiŝtempo: 16-a de januaro 2024